8種複合遺伝子RNA治療とは
遺伝子は,mRNAを作るコーディング領域と,その遺伝子の発現調節に働くノンコーディング領域からなっていますが,例えばGATA3は、ノンコーディング領域の「GATA」配列を認識して結合し,その周囲にあるコーディング領域からmRNAを作らせる(あるいは作るのを止めさせる)指令を出すのが,転写因子であるGATA因子です.このように,さまざまな転写因子が,それぞれDNAの特別な配列を認識,結合し,周囲のmRNAの発現を活性化したり,抑制したりします。当研究会の臨床研究では8種類のがん抑制因子のRNAを内包したエキソソームによる治療に取り組んでいます。
戦略1
細胞周期時計を止める
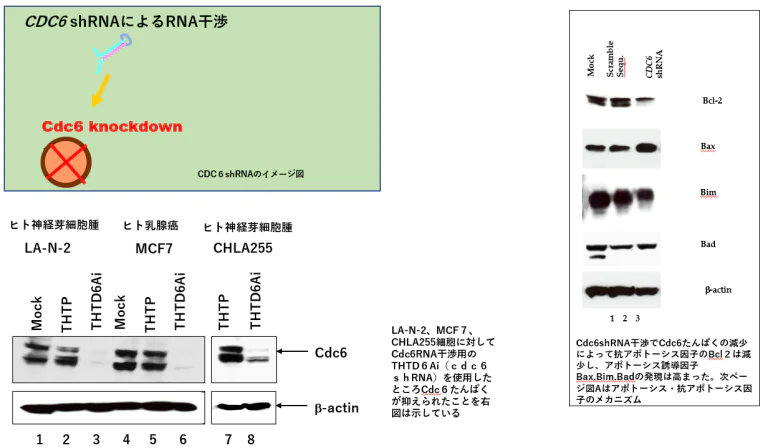
Cdc6ノックダウンshRNA(THTD)によるCdc6mRNAを標的としたRNA干渉
By Cdc6shRNA,RNA interference has the target of Cdc6mRNA.
転写因子E2Fタンパク質を標的とする=Rbタンパクの脱リン酸化=Rbがん抑制遺伝子産生タンパク質の活性化
Transcription factor E2F protein targets. Activation of dephosphorylation = Rb tumor suppressor gene producing a protein
細胞増殖性タンパク質Cdc6を標的とした非浸潤性がん陽性:CDC6 shRNAを産生するRNA治療:NICE治療
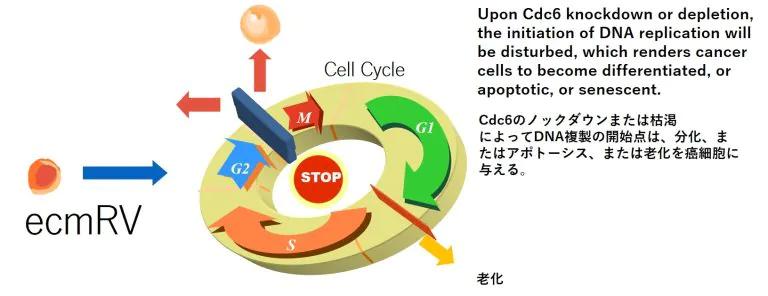
CDC6をノックダウンもしくは、枯渇することで、DNAの複製の開始を阻害します。
戦略
2がん微小環境の改善
Cdc6nkshRNAによってがん微小環境の腫瘍随伴マクロファージの形質転換
がん微小環境を変える Cdc6ノックダウンshRNA-ecmRV
Cdc6nkshRNA-ecmRV
TAMを標的としてこれをM1に形質転換し[がん微小環境]を改善する。抗がん剤成分の送達の効率を上げるために、複合的に使用するEZH2、p53、p16、PTEN、GATA3、MSK1、Klothoといったがん抑制遺伝子が作り出す抗がん作用を有するタンパク質を産生するRNAを効率的に標的細胞に作用させるエクソソームの一種であるecmRV-RNAを開発しました。
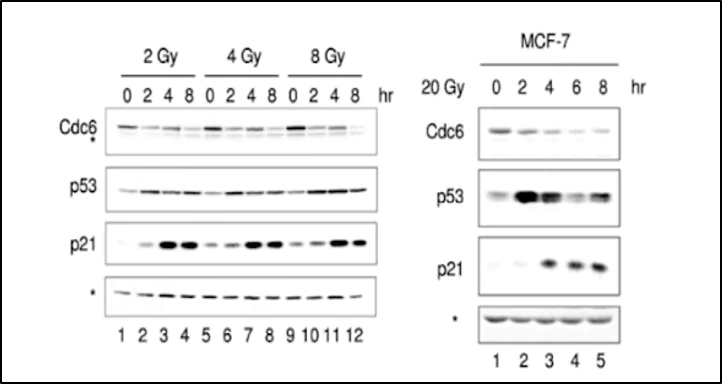
MCF-7(1970年69歳の女性から分離された乳がん細胞株)に放射線2Gy、4Gy、8Gy、20Gy 照射でCdc6、P53、P21の発現量のデータは左図のように放射線ストレス後時間と共に変化します。Cdc6の発現を抑えることでP53やP21の発現量は上昇します
戦略3
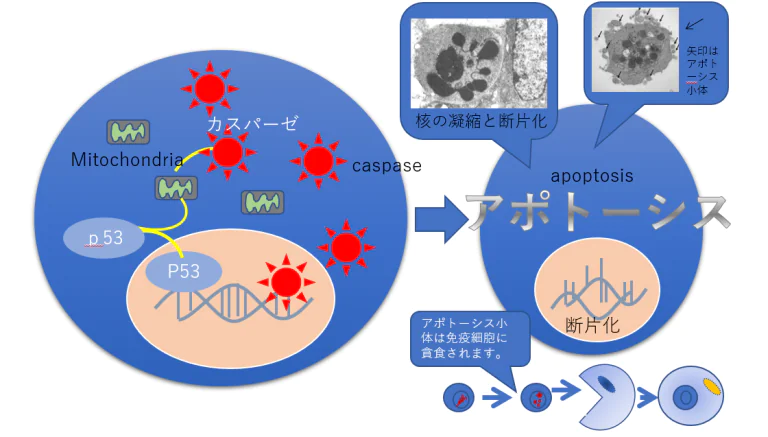
アポトーシス(細胞の自殺)の誘導
ゲノムの守護神・P53遺伝子によるアポトーシス
カスパーゼによるアポトーシス(細胞の自殺)
戦略4
Rbがん抑制遺伝子の活性化のためのフォローとしてP16 とP21 活性役として:MSK1RNA
転写因子E2Fタンパク質を標的とする=Rbタンパクの脱リン酸化=Rbがん抑制遺伝子産生タンパク質の活性化
8)MSK1
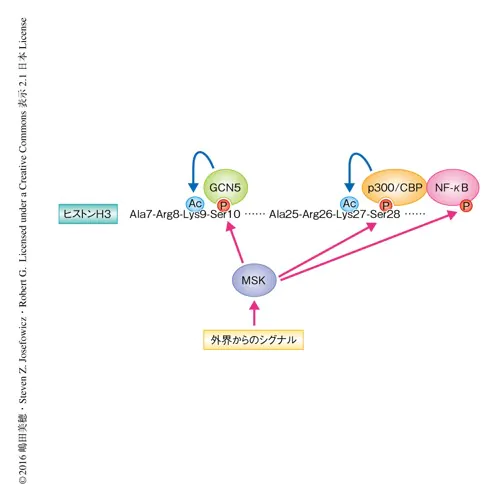
ヒストンH3のリン酸化したSer28はヒストンアセチル化酵素p300/CBPと直接に結合し転写を促進することが実証された.また,MSKはヒストンをリン酸化するだけでなく転写因子もリン酸化することにより,特異的な遺伝子発現の活性化をさらに促進する
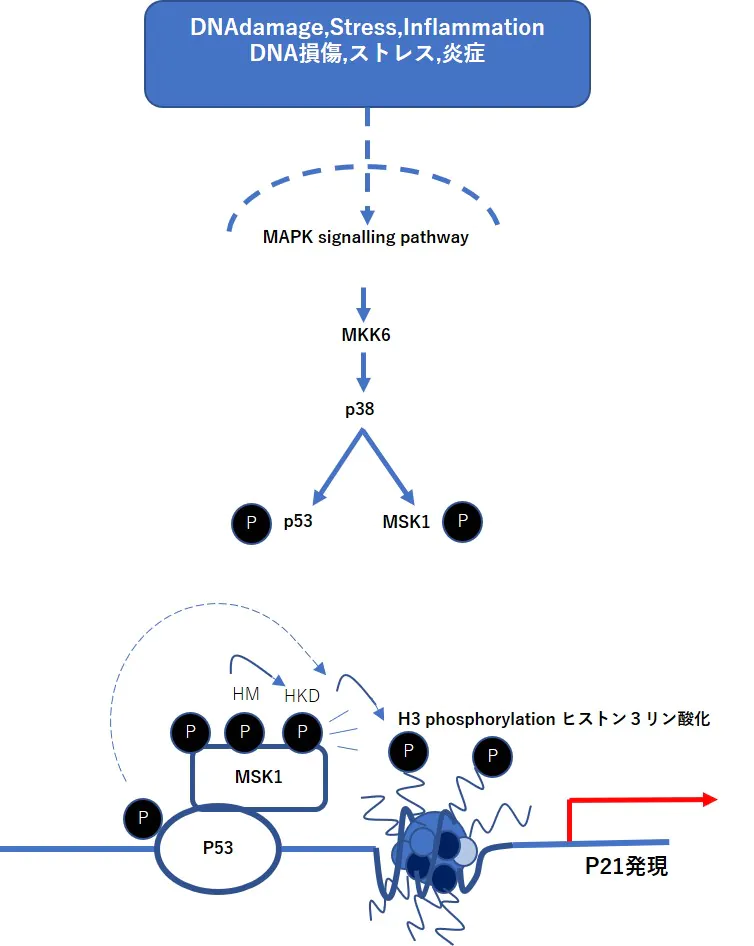
p38 MAPKは、p53およびMSK1/2の2つの下流標的をリン酸化し、p53応答性p21遺伝子の転写を刺激するために協働的に作用する: (i)p38はp53をリン酸化し、そのタンパク質安定性および転写活性を増加させる。 (ii)p38依存性リン酸化は、疎水性モチーフ(HM)におけるリン酸化事象によって獲得された負電荷によって刺激されるNKDの自己リン酸化を誘発し、次いでMSK1のヒストンキナーゼ活性を活性化する; (iii)活性化MSK1はp53との直接相互作用を介してヌクレオソームリン酸化をリン酸化し、p21転写を増加させる
MSK1 regulates luminal cell differentiation and metastatic dormancy in ER+ breast cancer
乳がんの多くの患者にとって、何年もの潜伏の後に症候性骨転移が現れる。微小転移性病変がコロニー形成を開始する前に休眠状態および検出不能なままである方法は不明である。ここでは、エストロゲン受容体陽性(ER)乳癌の骨転移潜時に関与するメカニズムについて述べられている。MSK1キナーゼを乳癌における転移性休眠の重要な調節因子として同定された。ER乳癌患者では、低MSK1発現は早期転移と関連している。MSK1のダウンレギュレーションが乳癌細胞の分化を損ない、骨のホーミングおよび増殖能力を増加させることを明らかにした。MSK1は、GATA3およびFOXA1転写因子を含む管腔細胞分化に必要な遺伝子の発現を、それらのプロモータークロマチン状態を調節することによって制御する。MSK1がER乳がんの転移性進行を予防することを示しており、MSK1発現に基づいて乳がん患者を早期再発のリスクが高いまたは低いと層別化することで予後を改善できることが示唆された。
The pathway of P16INK4-pRB tumor suppressor gene from CDC6
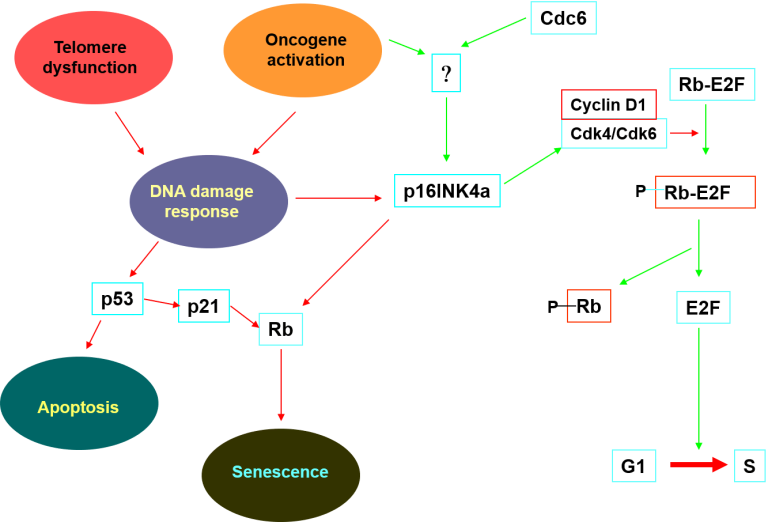
Adapted from J. M. Sedivy, Cancer Cell, 11:389-391, 2007 This figure is the basic treatment of our strategy.
Cdc6RNA干渉とRポイントにおける細胞周期制御

- RBはがん抑制遺伝子が産生する細胞周期を停止させる際に重要なたんぱく質
- 増殖シグナルが伝達されるとサイクリン・CDKが活性化
- サイクリン・CDKはRBをリン酸化することでRBの機能を抑制
- 肌の艶、肌理の改善
- E2Fが活性化し細胞周期が進行する
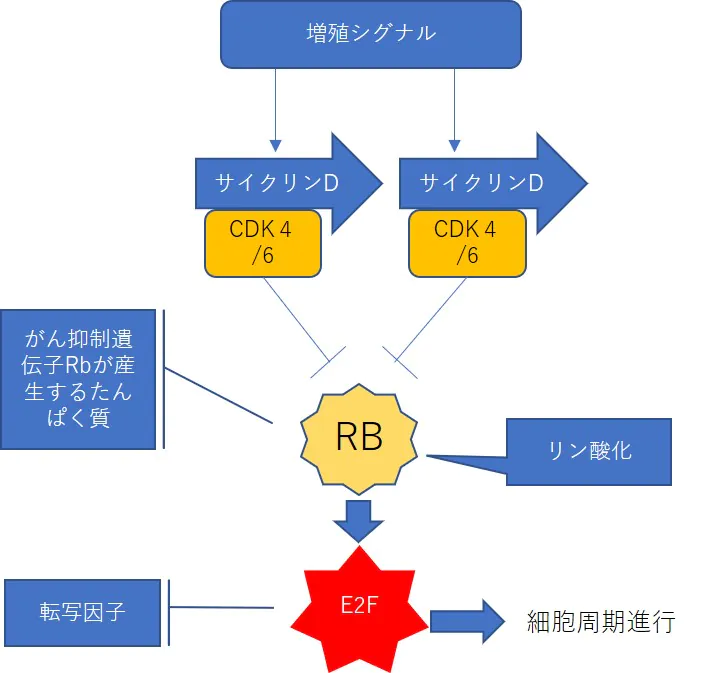

Cdc6shRNAを発現させ、CDC6たんぱく質の発現を抑制し、P16 を発現させるとRBのリン酸化は急激に抑えられ脱リン酸化したRBはE2Fを抑制し転写因子の遺伝子は発現されない
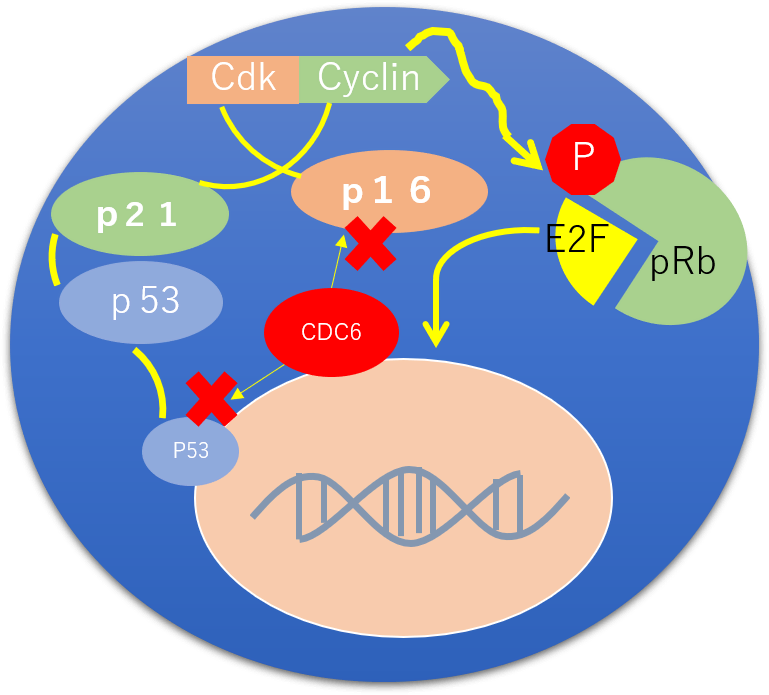
INK4/ARF遺伝子座は、3つの腫瘍抑制因子(p15INK4b、ARFおよびp16INK4a)をコードしており、ヒトのがんにおいて最も高い頻度で不活化されている遺伝子座の1つである。しかしながら、この遺伝子座の発現を支配する機構についてはほとんど解明されていない。私たちはINK4/ARF遺伝子座におけるDNA複製起点と推定される場所を同定した。INK4/ARF遺伝子座は、Cdc6、Orc2およびMCMを含む多タンパク質複合体を組み立て、また、保存された非コードDNAエレメント(調節ドメインRDINK4/ARF)に一致する。RDINK4/ARFを標的として局所化させたRNA干渉誘導によるヘテロクロマチン化により、この遺伝子座の転写が抑制され、このことからRDINK4/ARFが転写調節エレメントに相当することが明らかになった。Cdc6はヒトのがんで過剰に発現しており、DNA複製以外にも役割を担っている可能性がある。Cdc6の発現レベルが高くなると、RDINK4/ARF依存的な転写抑制、ヒストン脱アセチル化酵素の動員およびINK4/ARF遺伝子座のヘテロクロマチン化が起こり、この遺伝子座によってコードされる3つの腫瘍抑制因子の発現も同時に低下することがわかった。この機構は酵母における複製因子による交配型HM遺伝子座のサイレンシングによく似ている。INK4/ARF遺伝子座を抑制する能力と一致して、Cdc6は発がん性Rasとの協働による細胞の不死化活性と腫瘍性形質転換能をもつ。さらに、Cdc6の発現レベルが高いヒトの肺がんではp16INK4aの発現レベルが低い。我々は、Cdc6の異常な発現はRDINK4/ARFエレメントを介して直接INK4/ARF遺伝子座を抑制することにより発がん性を示すと結論する。
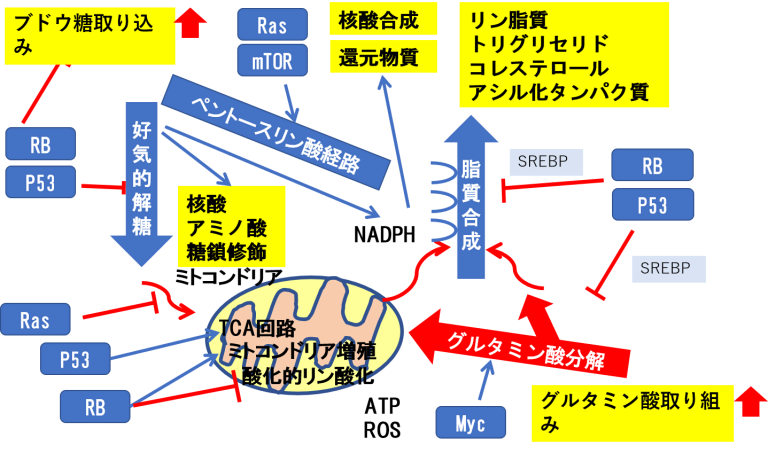
がん遺伝子やがん抑制遺伝子の産物が細胞の代謝を制御するメカニズム
戦略5
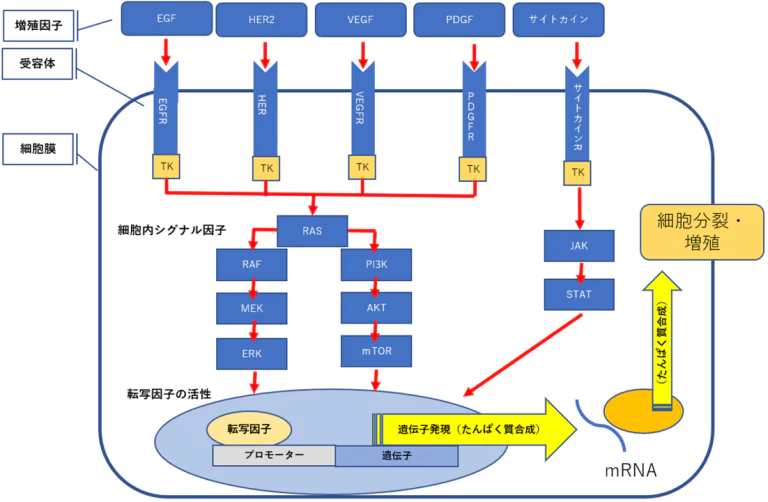
チロシンキナーゼ受容体下流の細胞増殖シグナル停止・RAS/mTOR・AKTの不活化へ
戦略6
がん抑制遺伝子FOXOの活性化とMYC、JUN、FOSがん原因遺伝子の停止:KLOTHO‐encordingRNA
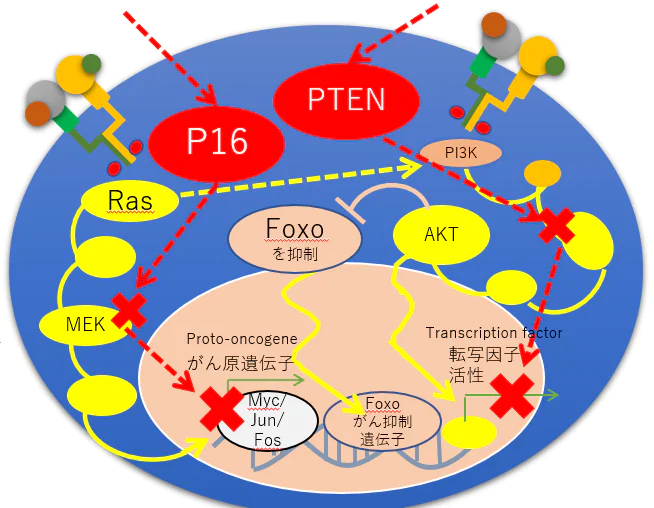
P16とPTENがん抑制遺伝子はここで働く
チロシン受容型キナーゼ下流の細胞増殖のシグナルは、PI3K/AKTの経路とRAS/MAPKの経路がある。
Tyrosine receptor kinase Signal downstream of cell proliferation, there is a pathway RAS / MAPK & PI3K / AKT.
PTENとP16のがん抑制遺伝子を併用することは、それぞれの2つの細胞増殖シグナルを阻害させる為にも有効な治療と考えられる
It is used in combination with a tumor suppressor gene PTEN and P16 is considered to be an effective treatment in order to inhibit each of the two cell proliferation signal
遺伝子治療は、細胞内で働く。つまり、がん抑制遺伝子が導入された細胞は、がん抑制遺伝子産生たんぱく質を発現する
Gene therapy, work in the cell. In other words, cells that tumor suppressor gene has been transfected can express tumor suppressor genes producing proteins
P16は、RAS/MAPKの経路を阻害する
PTENは、PI3K/AKTの経路を阻害する
P16 and PTEN tumor suppressor gene work here
SODは、スーパーオキシドアニオン(O2)を酸素と過酸化水素(H2O2)へ変換する酸化還元酵素。
銅イオンと亜鉛イオン(Cu, ZnSOD)、マンガンイオン(MnSOD)、鉄イオン(FeSOD)などの金属イオンを持った酵素。
細胞質(Cu, ZnSOD) やミトコンドリア(MnSOD)に多く局在している。
寿命と相関するSOD活性
酸素消費量の多さに対してSOD活性の強さは、寿命と相関があると言われている。 SOD1は、細胞液中 SOD3は細胞外に存在する。
SOD-2(MnSOD)
ミトコンドリア内に存在し、ミトコンドリアで産生されたスーパーオキシド(ーO2)を毒性の低い過酸化水素と酸素に変換。
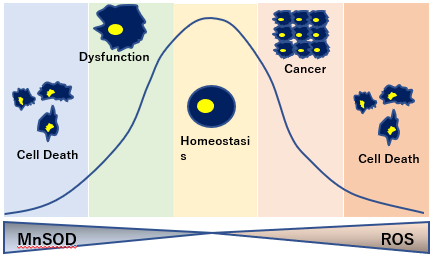
トレードオフ関係にあるSOD量
癌細胞を死滅させるにはスーパーオキシドが必要なため、SOD2が過剰にありすぎると、腫瘍転移の増大につながる。
一方でSODの過剰生産は活性酸素であるスーパーオキシドを抑制し、ハエの寿命を20%増加させるなど、SODの生産量はトレードオフの関係にある。
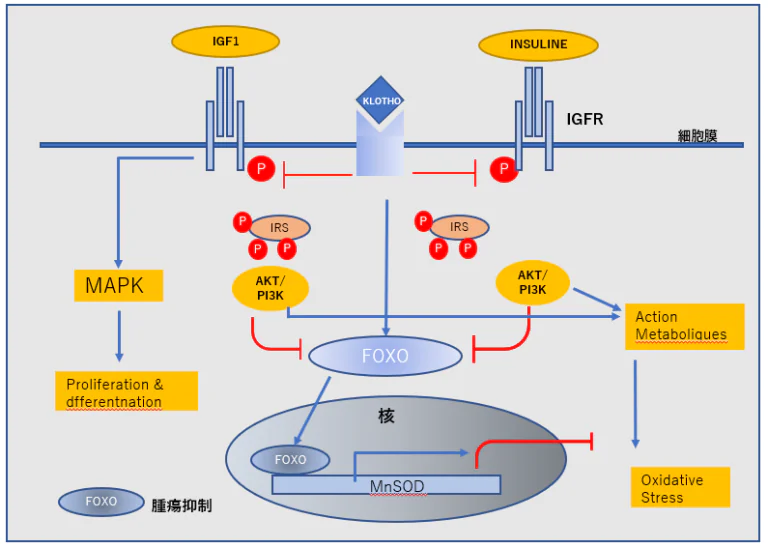
Klothoはがん領域にとどまらない重要な遺伝子
アミロイドβへの影響 SOD2の過剰発現は、アミロイド班の沈着を減少させ、ADマウスの記憶障害を改善する。
http://www.ncbi.nlm.nih.gov/pubmed/19666610/
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2815734/
MnSODノックアウトマウスでは、脳内のアミロイドβレベルおよびアミロイドβの負荷を有意に増加させる。
http://www.ncbi.nlm.nih.gov/pubmed/15147524/
SOD2の欠損は、アミロイド負荷を悪化させ、リン酸化タウレベルを増加させる。
http://www.ncbi.nlm.nih.gov/pubmed/17579710/
アルツハイマー病の治療標的としてのSOD-2活性
http://www.ncbi.nlm.nih.gov/pubmed/16687508
パーキンソン病、レビー小体型認知症患者での高いMn-SOD発現
http://www.ncbi.nlm.nih.gov/pubmed/19298851
MnSODの神経保護効果
http://www.ncbi.nlm.nih.gov/pubmed/9482791/
戦略7
アポトーシスを阻害するBCL2の発現停止:Cdc6ノックダウンshRNA&EZH2ノックダウンshRNA
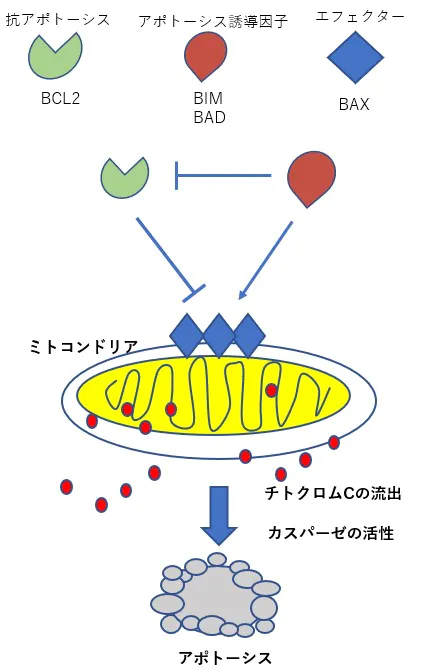
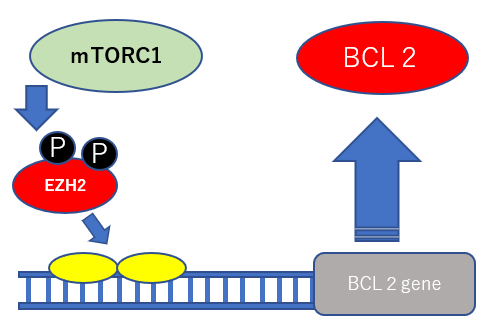
BCL2の発現を抑えるためにEZH2RNA干渉によってEZH2たんぱく質の産生を妨げる。 mTORの発現はEZH2を活性化するのでこの上流のTHKのシグナルの抑制にPTEN、P16を効果的に使用する
戦略8
活性酸素ROS阻害/SOD産生:Nrf2の発現→GATA3 ミトコンドリアの質量増
GATA3
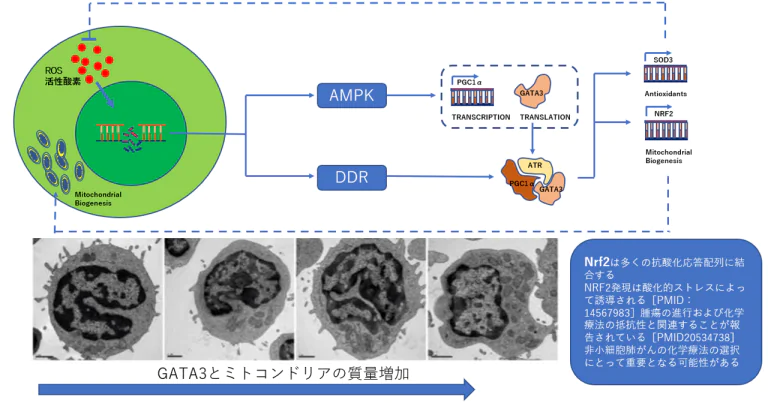
■GATA3は、CD4+ Tヘルパー2(Th2)細胞の分化を駆動する系統特異的転写因子であるが、他のT細胞および非T細胞系譜における免疫調節、増殖および維持などの様々なプロセスにも関与している。CD4+ T細胞がGATA3およびAMPKの作用を介してDNA損傷に応答してミトコンドリア質量を増加させるために利用されるメカニズムを示す。
■活性化AMPKは、PPARGコアクチベーター1アルファ(PPARGC1AまたはPGC1αタンパク質)の転写レベルおよび翻訳レベルでGATA3の発現を増加させ、一方、DNA損傷はナーフ2(NFE2L2またはNRF2)の発現を増強する。PGC1α、GATA3およびNRF2複合体はATRと共にミトコンドリア生合成を促進する。
■GATA3は単にCD4+ Th2細胞分化を制御するだけでなく、多くの機能的役割を有することが示されている。これらの役割には、NKT細胞の発生、ナチュラルキラー(NK)細胞の成熟とホーミング、CD8+ T細胞の調節と活性化が含まれます。GATA3がミトコンドリアの生合成、細胞代謝、ならびにミトコンドリアシグナル伝達軸に対する核を介したタンパク質を調節する抗酸化応答を調節し得ることを示す。GATA3およびAMP活性化プロテインキナーゼ(AMPK)は、DNA損傷応答によって活性化され、それによってpAMPKはペルオキシソーム増殖剤活性化受容体γコアクチベーター-1α(PGC1α)の転写およびGATA3の翻訳を増加させる。PGC1αおよびGATA3は、セリン/スレオニンプロテインキナーゼATR(ATR)および核因子赤血球2関連因子2(NRF2)と複合体を形成し、ミトコンドリア生合成を増強し、DNA損傷中のCD4+ T細胞の生存率を維持する。