がんを死滅させるがん温熱療法(ハイパーサーミア)
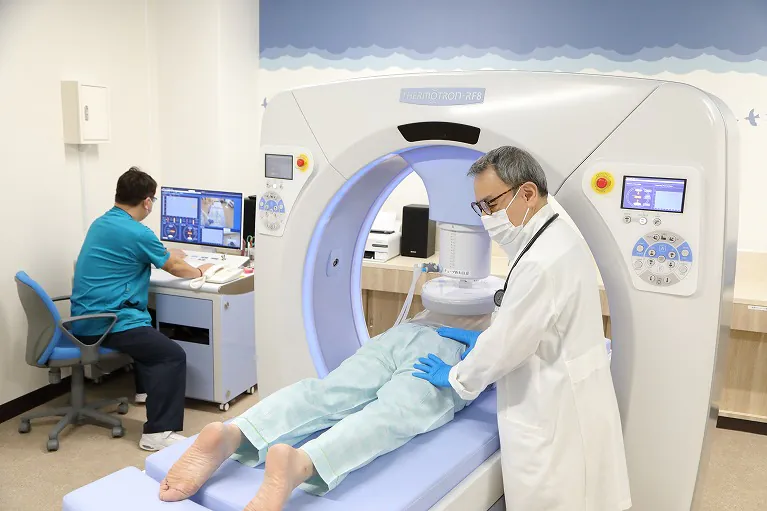 ハイパーサーミア療法とは、身体の外側から高周波電流を流し、がん細胞を死滅させる温熱療法です。
ハイパーサーミア療法とは、身体の外側から高周波電流を流し、がん細胞を死滅させる温熱療法です。
がん細胞が正常組織と比べて熱に弱い(42・5℃以上で死滅)特性を持つことを利用し、がん細胞のみを攻撃する治療です。
また、化学療法や放射線治療と併用することで、それぞれの治療の効果を高めることも期待できます。
保険診療で受けられる治療です。
| 治療時間 | 約40分/1回 |
|---|---|
| 治療回数・頻度 | 症例によって回数、頻度は異なります。
|
| 副作用 | 稀に、以下のような副作用が発生します。いずれの場合も、通常は軽微なものに留まります。
|
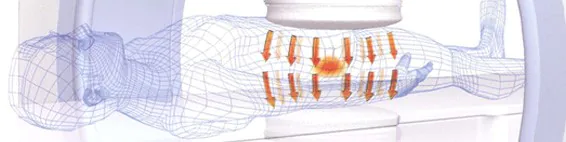
どのようにしてがん組織を加熱するのか?
患部を電極で挟み、そこに高周波電流を流します。
赤外線や紫外線では体表しか温められませんが、8メガヘルツの高周波であれば、身体の奥深くまで浸透し、がん細胞に作用します。
なお、正常細胞は熱を放散する働きを持ちますが、がん細胞はその働きが低下しています。がん温熱療法(ハイパーサーミア)では、そのことを利用し、がん細胞のみを42・5℃に至らしめ、死滅させます。
がん温熱療法(ハイパーサーミア)が対象となる疾患
がん温熱療法(ハイパーサーミア)による治療が可能な疾患について掲載いたします。
なお、脳・眼球・血液の疾患は対象となりません。また、進行の程度や身体の状態によっては、以下に該当する場合であっても、がん温熱療法(ハイパーサーミア)を実施できないことがあります。
- 頭頚部がん
- 食道がん
- 胃がん
- 肺がん
- 乳がん
- 悪性黒色腫
- 膵臓がん
- 胆管がん
- 肝臓がん
- 腎臓がん
- 前立腺がん
- 膀胱がん
- 直腸がん
- 肛門管がん
- 子宮がん
- 卵巣がん
- 骨転移
- 軟部肉腫
がん温熱療法(ハイパーサーミア)が受けられない方
以下に該当する方は、がん温熱療法(ハイパーサーミア)を受けることができません。予めご了承ください。
- 心臓ペースメーカー、埋込型除細動器、人工内耳を使用されている方
- 加温範囲にステントなどの金属を留置している方
- 加温範囲に金属粉を使った刺青、タトゥーをしている方
- シリコンなど豊胸材を埋め込んでいる方
- 全身状態の悪い方
- 栄養状態が著しく悪い方
- 心臓、腎臓の機能が低下している方
- 妊娠中、出産直後の方
- 乳幼児
- 意志疎通の困難などによって治療に危険を伴う方
標準治療との併用
3大標準治療とがん温熱療法(ハイパーサーミア)は併用が可能であり、またその併用によって治療効果の増大が期待できます。
手術との併用
手術前にがんを小さくするために、化学療法・放射線治療を行うことがあります。その際、さらにがん温熱療法(ハイパーサーミア)を併用することで、より高い縮小効果が期待できます。
化学療法との併用
がん温熱療法(ハイパーサーミア)による加温で、抗がん剤が細胞に取り込まれやすくなることが期待されます。
望ましい量の抗がん剤が使用できない場合にがん温熱療法(ハイパーサーミア)を併用することで、本来と同等の効果を得ることも可能です。
放射線治療との併用
放射線治療で傷ついたがん細胞の修復を、がん温熱療法(ハイパーサーミア)による加温で阻害することが可能です。特に、42℃以上でその阻害が顕著になります。
また、放射線が作用しにくい環境(低酸素・低pH)に存在するがん細胞は、熱への抵抗性が低く、加温により治療効果を補うことが可能です。
がん温熱療法(ハイパーサーミア)の費用の目安
がん温熱療法(ハイパーサーミア)は、8回目までは健康保険が適用されます。それ以降については、自費診療となります。
なお、下記費用に加えて再診料、検査料等が適宜かかります。
8回目まで(保険診療)
| 3割負担の場合 | 1割負担の場合 | |
|---|---|---|
| 深部腫瘍 | 27,000円/1回 | 9,000円/1回 |
| 表在腫瘍 | 18,000円/1回 | 6,000円/1回 |
9回目以降(自費診療)
| 深部腫瘍・表在腫瘍 | 27,000円/1回(税込) |
|---|
深部腫瘍・表在腫瘍の区別
深部腫瘍
食道がん、胃がん、結腸がん、直腸がん、膵臓がん、胆管がん、肝臓がん、腎臓がん、前立腺がん、膀胱がん、肺がん、子宮がん、卵巣がんなど
表在腫瘍
頭頚部がん、乳がん、悪性黒色腫、肛門管がん、骨転移、軟部肉腫など
がん温熱療法(ハイパーサーミア)の注意事項
- 健康保険証をお持ちください。
- かかりつけ医からのからの紹介状、画像データをお持ちください。
- 汗をかきますので、汗を吸いやすくリラックスできる服装(Tシャツ、短パンなど)をお持ちください。また、水筒やペットボトルでのお飲み物をお持ちください。
- 指輪、ワイヤーの入った下着など、金属を含むものはすべて外していただきます。紛失などを避けるため、貴金属類はできるだけ外した状態でお越しください。
- ご予約されたお時間の10分前にはご到着くださいますようお願いします。
- 理由にかかわらず、遅刻・無断キャンセルの場合は1回分の治療費がかかります。
- 治療時間は約40分です。事前にお手洗いをお済ませくださいますようお願いします。
がん温熱療法(ハイパーサーミア)Q&A
治療は、すぐに受けられるのでしょうか?
治療内容の説明を受け、同意書にサインをいただければ、治療日を決定し、施行の流れとなります。
他の患者様のご予約の状況にもよりますが、できるだけ早く治療を受けていただけるように努めております。
治療の流れを教えてください。
治療台に横になり、照射する部位を電極で挟み、約40分加温します。準備時間を含めると、約60分の治療となり、そのあいだは腹ばいになっていただきます。
皮膚にピリピリとした刺激を感じることがありますが、電極の位置を調整すれば解消します。ピリピリ感を感じたときには、医師にその旨を伝えてください。
抗がん剤治療や放射線治療を受けている場合、がん温熱療法(ハイパーサーミア)を並行して受けられますか?
はい、可能です。
抗がん剤治療との併用で、抗がん剤ががん細胞へと取り込まれやすくなる効果が期待できます。また、放射線療法との併用では、放射線で傷ついたがん細胞の修復を阻害する効果が期待できます。
入院は必要ないのでしょうか?
必要ありません。
がん温熱療法(ハイパーサーミア)は、日帰りで受けていただけるがん治療です。
温熱遺伝子複合治療
ゲノムの守護神p53遺伝子とは?
p53タンパク質は SV40 によってがん化した細胞から同定され(Lane and Crawford, 1979)、その遺伝子であるp53遺伝子はがん遺伝子の一つとして知られています。その産物であるp53タンパク質は腫瘍抑制因子と考えられており、細胞が遺伝的毒性を持つようなストレスにさらされた際に、
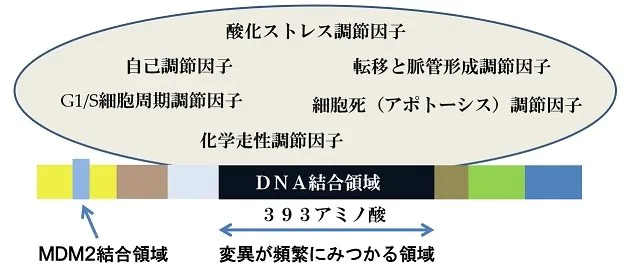
細胞周期を停止させたり、アポトーシスを誘導したりすると言われています。
ヒトの腫瘍において半数以上でp53遺伝子に変異が確認されており、転写活性を失った変異p53タンパク質が産生されています。また、正常なp53タンパク質は非常に不安定であるのに対し、変異p53タンパク質は安定で、腫瘍細胞内に大量に蓄積されます。
がん治療でよく見られる放射線や抗癌剤などは細胞に対してストレスとなり、p53が活性化・蓄積することによりp53シグナリングが働くことで細胞が死滅します。しかしながら、p53に変異をもつ腫瘍細胞は、p53のシグナリングが正常に機能しないため、それらの治療に抵抗性を示します。そこで、変異p53が正常に機能するように操作することが、がん治療にとってかなり有効な手段であり、新しいがん治療戦略の一つであると言えます。
p53は、がんの抑制に関わっている一方で、腫瘍細胞においてはp53の変異が多く見られ、p53経路が崩壊していることから、p53の機能を正常に回復させることが出来れば、がん治療(放射線治療や化学療法)への感受性を高められるであろうと考えられています。このような観点から、新たながん治療の戦略として、腫瘍細胞における変異p53の機能回復を目的とした研究が多数なされています。
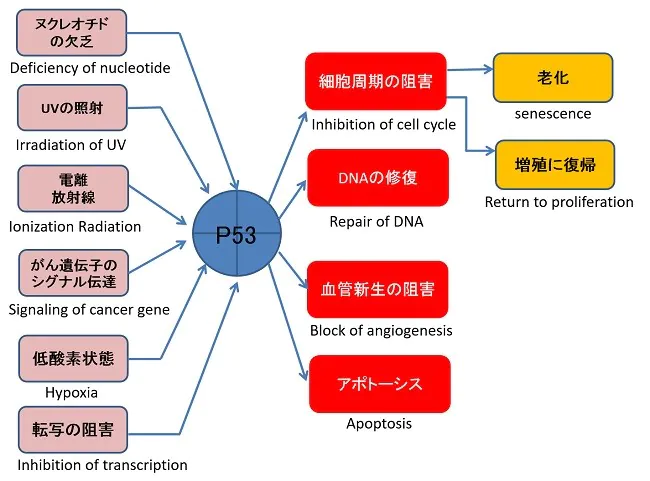
しかしながら、がん細胞では、MDM2によって正常P53は急速に分解されることが知られ、また、変異 p53が存在することでドミナントネガティブ効果によりその機能が不活化されてしまうため、使用が制限されてしまう可能性もあります。
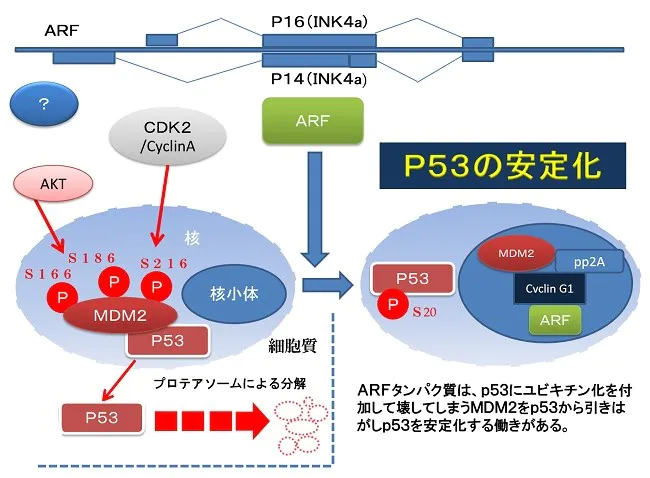
キョウチクトウなとどの植物に含まれるアルカロイドの一種であるellipticineは、古くからトポイソメラーゼⅡ阻害効果を持ち、抗腫瘍効果を有することが知られています。ellipticineとその誘導体数種は R175HやR248Wなどさまざまな変異p53の転写機能を回復します(Peng et al., 2003)。ellipticineは変異p53の構造を変え、DNA結合活性を回復させます。また、変異p53に依存してアポトーシスを誘導し、マウスへの移植腫瘍においても変異p53の活性化を引き起こします。ellipticineは contact mutant とstructural mutantの両方に作用し、また温度感受性変異においても効果が見られるようです。CP-31398 はp53の熱変性に対して防護するのに対して、ellipticineにそのような効果は見られず、CP-31398とは違った作用機序であるのかもしれません。いずれにしても、変異p53に対するellipticine の明確な作用機序は不明です。
変異p53の構造を正常なp53の構造に変える方法として、化学シャペロンを用いた方法も行われています。シャペロン (chaperone)とは、変性あるいは変異によって失活してしまったタンパク質の構造を元の構造に変化させ、活性を取り戻させる働きを持つ分子のことを言います。シャペロン機能を持つ低分子化合物は化学シャペロンと呼ばれ、glycerolやtrimethylamine N-oxideなどが知られています。1997 年、Brownらによって、温度感受性p53の機能が、これら2つの化合物のシャペロン機能を用いることで回復するという報告がなされました(Brown et al., 1997)。続いて、Ohnishiらは、変異p53を保持する T98G細胞やA7細胞においてglycerol処理と温熱処理の併用におけるp53下流遺伝子産物である P21/WAF1の誘導を確認しました(Ohnishietal.,1999a)。これは、併用処理によるp53のDNA結合活性の回復に伴うものであり、その結果、アポトーシスの誘導も観察されています(Ohnishi et al., 1999b)。この効果は、glycerolと温熱の併用のみではなく、glycerolとX線処理の併用や、glycerolと白金製剤であるCDDPの併用処理でも観察されます(Ohnishi et al., 2000; Yuki et al., 2004a; Yuki et al., 2004b)。このように、glycerolはp53の構造変化を誘導し、変異p53を正常な機能に回復すると言えます。
化学シャペロンは、リン酸化をうけた変異p53に対して、構造変化を促し、p53下流遺伝子の発現が誘導できるようにします(Ohnishi et al., 2001; Ohnishi et al., 2002 を引用)。
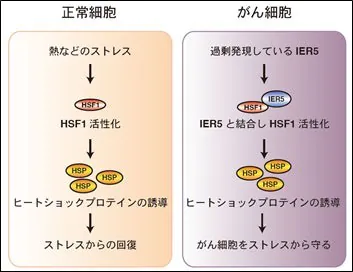
熱など、タンパク質の構造を変化させる要因によって誘導されてくる熱ショックタンパク質(heat shock proteins,HSPsと略)は、分子シャペロンとして細胞を環境ストレスから防護するように働いています(HSPs と分子シャペロンはほぼ同義)。このHSPsは特異的な転写因子であるHSF1(heat shock transcription factor 1)によって発現が制御されています。HSF1および分子シャペロンはまた、タンパク質凝集が原因となる神経変性疾患などの症状改善にも役立つことが示されています。したがって、HSF1および分子シャペロンは生体にとって有益な防御機能を持つと長らく考えられてきました。しかし 2007年に、HSF1はがんの発生や増殖を促進するという、衝撃的な論文が報告されました。それと相前後してHsp90やHsp70など、個々の分子シャペロンも、がんの発生、増殖、浸潤、転移などに関わる因子の機能を制御することにより、がんの進展を助けているという結果が多く報告されてきています。このように生体を防御するために働く因子が、逆にその生体に発生したがん細胞の増殖を助けて、その生体を苦しめることになるという、一見矛盾した皮肉とも見える機能を持っています。
国立研究開発法人国立がん研究センター(理事長:堀田知光、東京都中央区、略称:国がん)は、これまでがん化との関連が解明されていなかったIER5(転写因子)遺伝子が、がん細胞の増殖に関与していることを世界に先駆け発見しました。また、IER5遺伝子は、腎がん、大腸がん、膵がんなど様々ながんで発現上昇することも示され、IER5を分子標的として阻害することで、がんを抑制できる可能性が示唆されました。
本研究成果は、国立がん研究センター研究所(所長:中釜斉)希少がん研究分野主任研究員 大木理恵子の研究グループが行ったもので、英科学誌ネイチャー(Nature)系オンライン科学誌「サイエンティフィック・リポーツ(Scientific Reports)」に1月12日午後7時(英国時間同日午前10時)付けで掲載されました。
・がん細胞の増殖に必要とされる遺伝子IER5を発見した。
・がんで過剰発現したIER5は、HSF1と結合することでヒートショックプロテインを誘導し、ストレスからがん細胞を保護することによりがん細胞の増殖に寄与するというメカニズムを解明した。
・IER5の機能を阻害することで、がんを抑制できる可能性を示唆した。
正常細胞では、HSF1 (Heat Shock Factor 1)という転写活性化因子の活性が低く保たれていますが、HSF1は熱ストレスなどにより活性化し、ヒートショックプロテイン(Heat shock protein: HSP)を誘導することで、ストレスから回復することが分かっています。近年、HSF1は、がんの発生や悪性化にも関わっていることが報告されましたが、そのメカニズムは明らかとなっていませんでしたが、2016年のIER5遺伝子の解明により温熱療法機器の使い方に関して単なる温熱療法という考え方だけでは、がんの治療としては十分な効果は得らないという重要事項が示唆されたと言えます。
本研究会が推奨している温熱療法用の機器は、サーモトロンRF8です。これは、人体加温に最適な8MHz波(高周波)が採用されており、身体の表裏一対の電極をセットして8MHzの高周波を与えるキャパシティブ方式により身体内部に高周波電流が流れそのジュール熱により幹部の温度を上昇させる仕組みで、深部加熱を目的とした温熱療法機器です。
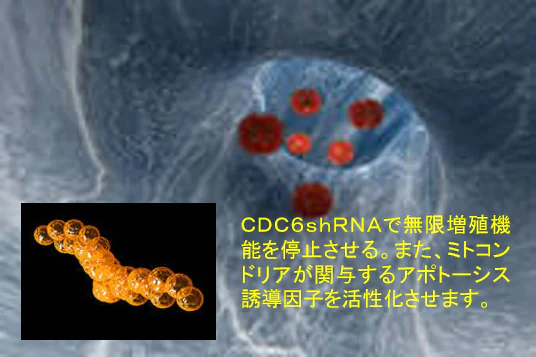
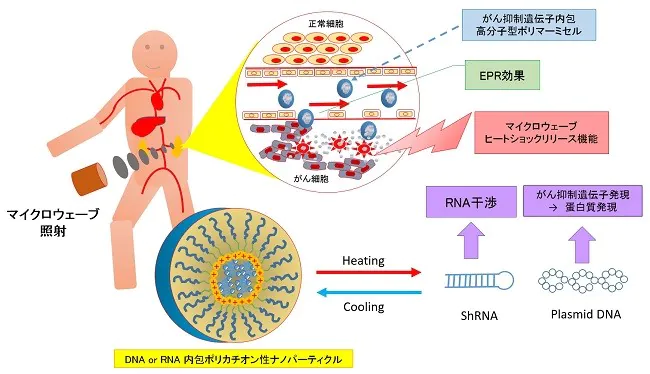
4種複合遺伝子製剤と温熱治療
研究開発支援プログラムで使用されている非ウィルス型ベクターRN‐P53、PTEN、P16、Cdc6shRNA(特許公開技術):開発名ecm-RV2022M4は、glycerolを素材にがん抑制遺伝子をカプセル化した遺伝子治療用4種のエンコードRNAナノ粒子材料です。
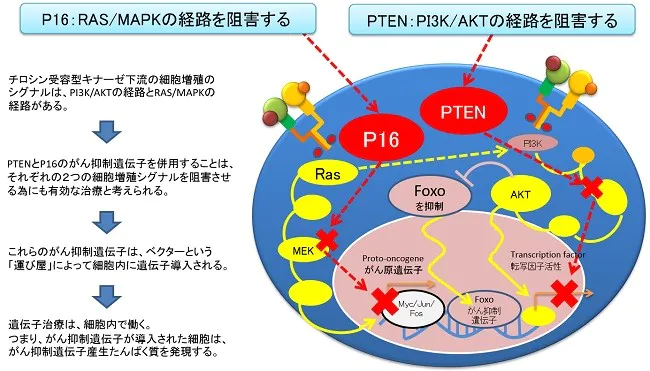
IRE5遺伝子の発現はSrcファミリーキナーゼのLynがこのIRE5の活性を阻害することが知られていることから、私たちは、PTEN、p16を使いチロシンキナーゼの受容体の活性シグナルを阻害すること。また、P53の活性のためにもMDM2の阻害をブロックするためにAKTを阻害することが重要であることから温熱治療に4種混合遺伝子を併用して温熱治療の効果のアジュバンド(アジュバンド=主剤に対する補助剤)として使用しています。
このカプセルは、200ナノメーター以下のサイズのナノパーティクルでEPR効果が期待できるものです。これをがん病巣付近で効率的に内包された遺伝子を放出する為のヒーティングを主目的として、細胞に過剰な温熱ストレスを与えるのではなく、EPR効果により、がん組織に集まるナノパーティクルの内包分子を温熱効果で放出させることがその最大の目的になります。
正常p53遺伝子をユビキチン化し分解するMDM2は、AKTに、依存的にリン酸化する為に、AKTを抑制する遺伝子とp53を安定化する遺伝子を内包したglycerolナノカプセルを複合的に投与します。これらを病巣付近で効率的にリリース(放出)させる為に極超短波によるエネルギーを病巣付近に照射する治療法です。
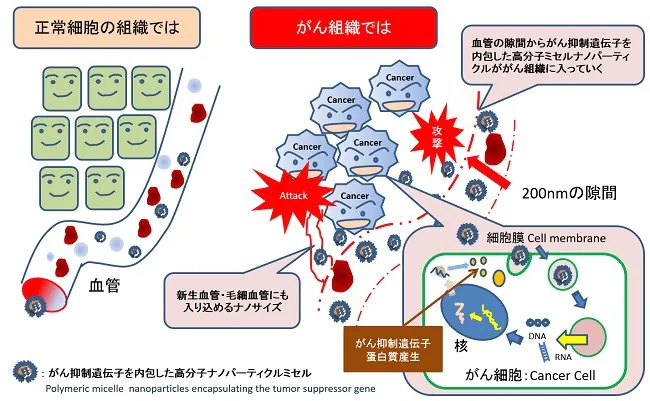
EPR(Enhanced permeation and retention)効果は1986年にDDS研究所前田浩教授が提唱した理論で、固型がん細胞に対してピンポイントでミサイル療法を行なうターゲティング療法の基本概念のことです。
固型がんつまり腫瘍細胞の周囲の新生血管は非常に不完全で、血管内皮細胞の間には空間が存在してしまいます。正常の血管には透過しない数百nmの高分子薬剤を腫瘍細胞の周囲の新生血管では血管壁を透過します。その結果、透過した高分子薬剤は腫瘍組織中に集積します。その透過特性と腫瘍組織にターゲティングした効果をEPR効果と呼んでいます。
EPR効果は、分子量40kDa以上の生体親和性のある高分子にみられます。EPR効果の重要な点は、腫瘍に対する単なるパッシブターゲティングだけでなく、腫瘍組織へひとたびデリバリーされた高分子型薬剤が長期(数週間)にわたり、その局所に留まること(retention)を意味しています。正常組織では、これら高分子や油滴はリンパ系により回収されます。これに対して腫瘍組織では、それらは長期にわたり滞留します。その理由は、固型腫瘍組織においてはリンパ系による高分子物質の回収が機能不全になっていることを示します。このことは、腫瘍に選択的なデリバリーと同様に重要です。

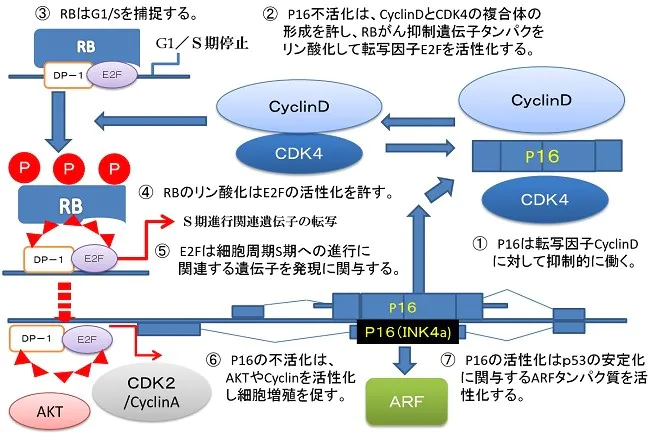
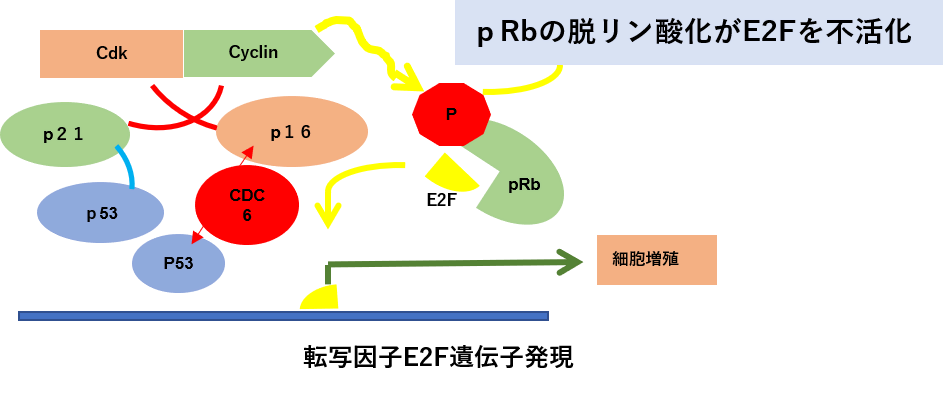
P16タンパク質の役割 CDKI(サイクリンの阻害)
P16とPTENがん抑制遺伝子はここで働く
Rbがん抑制遺伝子のリン酸化
Rbがん抑制遺伝子産生タンパク質がリン酸化されることで、増殖因子のE2Fたんぱくが活性化し細胞分裂の周期が時計が動き出す。
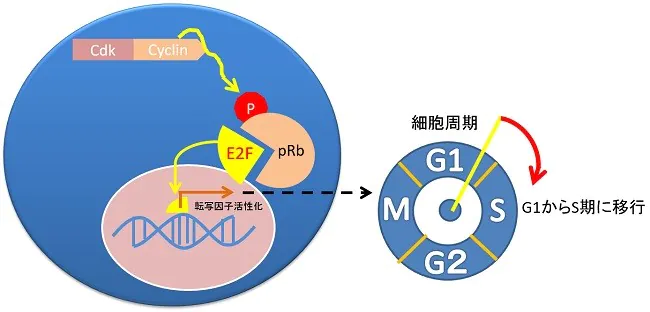
Rbがん抑制遺伝子のリン酸化の脱リン酸化の条件として、Cdc6タンパク質の産生を阻害するCdc6shRNAによるRNA干渉でCdc6たんぱく質の発現を抑制する。このことでP16 は活性化してサイクリンを不活化します。Cdc6たんぱく質の発現量とp53の発現量は反比例しますので、Cdc6のノックダウンはp53の活性化、p16がん抑制遺伝子、Rbがん抑制遺伝子の活性化、チロシンキナーゼ受容体の増殖シグナルの不活化といった効果をもたらします。
注目されるハイパーサーミアがん治療―そのしくみを科学する
細胞に温熱処理を施すと X 線の場合と同様に,生体内では細胞の運命を決定するキータンパク質であるがん抑制遺伝子産物 p53 を中心としたシグナルトランスダクションが誘導されることを我々が世界に先駆けて発見した.正常型 p53 遺伝子をもつがん細胞は変異型 p53 がん細胞に比べて温熱で Bax, Caspase-3 を経たアポトーシスが誘導されやすく,温熱に感受性であり,ハイパーサーミア治療に適している.しかし, 変異型 p53 がん細胞に対してもグリセロールや p53C 末端ペプチドを利用した分子シャペロン治療,アポトーシス促進・細胞分裂抑制を標的とした化学物質や siRNA を利用した標的がん治療,p53 遺伝子を利用した遺伝子治療などで有効な治療開発に成功してきており,臨床への応用が期待されている.現在のハイパーサーミア治療においても放射線療法,化学療法,外科療法との併用を行うことによって,より効率的ながん治療を工夫することもできる.いま,その治療増進のしくみを分子生物学的手法で科学している.
- ja (jst.go.jp) :PDFを読む:大西 武雄
奈良県立医科大学医学部医学科生物学教室











